Bir atomun elektron ilgisini, dolayısıyla kimyasal bağ yapma eğilimini gösteren özellik. Elementlerin elektronegatifliği, lityumunki 1,0 kabul edilerek bağıl olarak hesaplanmıştır (sodyumunki 0,9, azotunki 3,0 vb.). Periyodik cetvelde elektronegatiflik, satırlarda soldan sağa doğru artar, sütunlarda ise yukarıdan aşağıya doğru azalır. Dolayısıyla ametallerin elektronegatifliği büyüktür, bunların arasında da flüorun elektronegatifliği 4,0 olarak en büyüktür. Atomların elektronegatiflikleri arasındaki fark arttıkça, aralarındaki bağın iyonik özelliği de artar. Örneğin sodyum klorürü (NaCl) oluşturan sodyum ve klor atomları arasında sağlam bir iyonik bağ bulunur (sodyumun elektronegatifliği 0,9, klorunki ise 3,0'dır).
Elektronegatiflik Nedir?
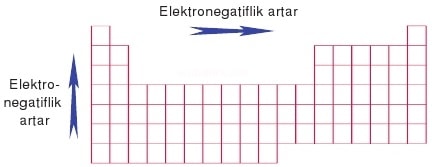
- elektronegatiflik
- elektronegatiflik nedir
- elektronegatiflik sıralaması
- elektronegatiflik hakkında bilgi
- ile ilgili
- periyodik tablo
Sayfada Elektronegatiflik Nedir? hakkında bilgiler sunulmaktadır, diğer bilgilere de bakabilirsiniz...
Elektronegatiflik Nedir? Hakkında Yorumlar
Yazılan son 1 yorum gösteriliyor.
İçerikle ilgili 1 yorum yazılmış.
Elektronegatiflik Nedir? ile ilgili bilgiler, hakkında kısaca yazı