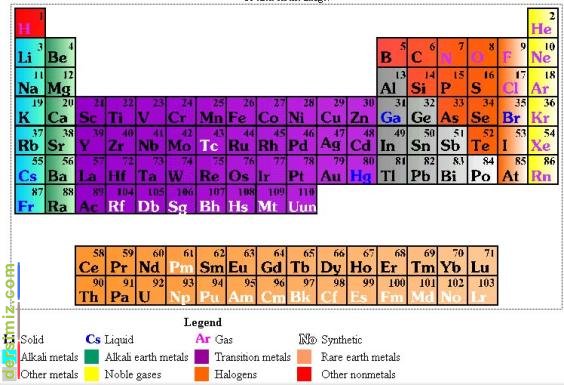
Dimitriy Mendeleyev tarafından keşfedilen ve daha sonra Henry G. J. Moseley tarafından gözden geçirilerek yenilenen düzenlemeye göre elementlerin sıralandığı tablo. Periyodik cetvel gruplara ve periyotlara bölünmüştür. Elementler, atom numaraları küçükten büyüğe doğru, bu grup ve satırlara yerleşir. Periyodik cetvelde 18 grup vardır. Grupların adlandırılması iki seri şekildedir:
A (mavi ve sarı) ve B serileri (kırmızı). A serisi 8 gruptan, B serisi ise 10 gruptan oluşur. Bir grup içinde yer alan bütün elementler en dış enerji seviyelerinde aynı sayıda değerlik elektronuna sahiptir ve dolayısıyla da aynı kimyasal özellikleri gösterirler. Bir periyotta sıralanan elementlerin ortak özelliği, aynı sayıda elektron kabuğuna sahip olmalarıdır. Bu kabuklarda yer alan elektron sayısı, ki elementin atom numarasıyla aynıdır, soldan sağa doğru artarak devam eder. Örneğin, 4. periyotta yer alan potasyum elementinin atom numarası 19, sonrasında yer alan kalsiyum elementinin 20 ve skandiyum elementinin 21′dir. Gruplar elementlerin ortak özelliklerine göre adlandırmalar da alır. Örneğin; IA grubu elementleri "alkali metaller", IIA grubu elementleri "toprak alkali metaller", VIIA grubu elementleri "halojenler" ve VIIIA grubu elementleri "soy gazlar" olarak adlandırılır. Latanitler (yeşil) nadir toprak elementleridir. Aktinitlerse (yeşil) radyoaktif elementlerdir.